terça-feira, 21 de agosto de 2007
Internet ameaça luta contra a sida
Uma verdadeira “teoria da conspiração” parece estar em curso em numerosas páginas da internet dedicadas a informar ou debater temas relacionados com a sida. Desde dizer que a indústria farmacêutica já desenvolveu a vacina, mas não quer vendê-la, ou que os americanos inventaram a doença, que o HIV nem sequer é a sua causa, e que o uso do preservativo não confere protecção, sendo por isso dispensável, de tudo um pouco pode ser lido em sites pouco fundamentados do ponto de vista científico, mas que estão tão ou mais acessíveis do que os outros ao comum dos cidadãos.
A denúncia é feita na edição desta semana da revista «PLoS Medicine», adverte que as consequências destas acções podem ser fatais e atingir dimensões consideráveis. Num artigo assinado por Tara Smith, especialista da Universidade de Iowa, e Steven Novella, da Universidade de Yale, volvidas mais de duas décadas de sucessivas investigações e avanços no conhecimento de como a patologia funciona, os médicos afirmam que “não pode haver dúvidas de que o HIV é o vírus que causa a sida”, insistindo na evidência de que a prevenção é a melhor maneira de agir no combate à doença. Lamentando que haja grupos de pessoas apostados em desacreditar na rede o trabalho dos numerosos cientistas que ao longo dos anos se têm dedicado a estudar o problema, os dois peritos afirmam que “quem discorda do que se sabe sobre a sida na internet nega a autoridade dos cientistas ou acredita que a maior parte deles se vendeu a outros interesses”. Esse descrédito, concretizam, poderá fazer com que quem acreditar nas mentiras publicadas nesses sites possa ter comportamentos prejudiciais, que coloquem em risco quem está são e sem problemas, designadamente através da prática de sexo desprotegido ou da adesão a terapias alternativas ineficazes e perigosas.
Carla Teixeira
Fonte: PLoS Medicine
Novo tratamento para o acne em desenvolvimento
Numa etapa inicial da Fase 1 do estudo em nove voluntários saudáveis, o tratamento demonstrou reduzir até 70 por cento a secreção de sebo pela pele, o que está associado ao desenvolvimento do acne. Os resultados da Fase 1 são surpreendentemente bons, segundo afirmou o director de desenvolvimento clínico da Summit, Nigel Blackburn. A redução da produção de sebo tem sido o alicerce da busca do tratamento para o acne durante 30 anos, mas tem havido pouco sucesso, à parte do Roaccutane, que apesar disso apresenta efeitos secundários significativos, acrescentou ainda Blackburn.
O tratamento privilegiado actualmente para o acne, o Roaccutane, pode provocar um amplo leque de efeitos adversos, incluindo a teratogenicidade, que leva a deficiências no feto em mulheres grávidas, e também tem sido recentemente ligado à depressão e (inconclusivamente) a suicídio nos adolescentes. O mercado para o tratamento do acne está avaliado em muitos milhões de dólares, e qualquer novo tratamento que seja desenvolvido sem efeitos secundários poderá potencialmente atingir vendas muito elevadas.
Apesar da Summit não ter revelado o nome do fármaco que está agora a ser avaliado, a companhia afirma que este representa uma classe de compostos completamente nova para o tratamento do acne. Nigel Blackburn afirmou que com as doses que estão a ser estudadas qualquer tipo de efeito adverso deverá ser ligeiro, em comparação com os que resultam da utilização do tratamento com Roaccutane.
A companhia espera começar os ensaios de Fase 2 no próximo ano, para avaliar a eficácia do fármaco em pessoas que têm acne. Dependendo dos resultados, o fármaco poderá ser formulado como um tratamento tópico individual ou, mais provavelmente, em combinação com outros tratamentos existentes. A Summit já iniciou conversações com diversas companhias que se mostraram interessadas, e que estão à espera de ver se os resultados iniciais podem ser repetidos num grupo de estudo mais alargado.
O acne
O acne é uma doença cutânea frequente, causada pela obstrução dos poros da pele, com a consequente formação de espinhas e abcessos inflamados e infectados (acumulação de pus) na face, pescoço e região anterior e posterior do toráx.
O acne surge geralmente na adolescência, afecta ambos os sexos, tendo uma maior prevalência dos 14 aos 17 anos no sexo feminino, e dos 17 aos 19 no sexo masculino, e atinge cerca de 80 por cento dos jovens e aproximadamente 30 por cento das pessoas continua a ter acne na vida adulta.
O acne afecta os adolescentes devido a uma interacção entre hormonas, sebo e bactérias que vivem na pele. Durante a puberdade aumenta a actividade das glândulas sebáceas da pele, com produção excessiva de sebo.
Isabel Marques
Descoberto possível indício para o tratamento da hipertensão
As conclusões deste estudo, publicadas na edição de 16 de Agosto de 2007 na “The Journal of Clinical Investigation”, apontam para o facto de que a inibição de certos factores solúveis poderá abrir caminho a novos tratamentos para a hipertensão.
Segundo os investigadores, a hipertensão está associada a um aumento do risco de ataques cardíacos e de acidentes vasculares cerebrais (AVC), e ao consumo frequente de fármacos anti-inflamatórios não-esteróides. Contudo, os investigadores desconhecem a razão pela qual estes fármacos provocam hipertensão, uma vez que estes inibem a produção de vários factores solúveis, as prostaglandinas, que podem afectar a pressão sanguínea. As prostaglandinas são substâncias semelhantes às hormonas, que alteram o diâmetro dos vasos sanguíneos, elevam a temperatura corporal como resposta à infecção e desempenham um papel crucial na coagulação do sangue. Todavia, desconhecem-se ainda os efeitos da inibição dos receptores individuais das prostaglandinas.
Quando estavam a tentar resolver esta questão, os investigadores identificaram um possível indício para o tratamento da hipertensão. No estudo é demonstrado que os inibidores do receptor EP1 da prostaglandina E2 (PGE2) reduzem a hipertensão em ratos. A descoberta de que os ratos que têm carência de EP1 estão protegidos contra os efeitos hipertensos dos antagonistas específicos da angiotensina II e de EP1 corrobora a descoberta anterior. Os autores sugerem que apontar ao receptor EP1 da PGE2 poderá ser uma forma viável para tratar a hipertensão.
O artigo pode ser consultado na íntegra em: The Journal of Clinical Investigation.
Isabel Marques
Fontes: www.correofarmaceutico.com, www.jci.org, www.manualmerck.net
Irregularidades com o Exelon não ocorrem em Portugal
As irregularidades detectadas há alguns dias nos Estados Unidos em diversos folhetos de promoção do Exelon, medicamento da Novartis utilizado no tratamento do Alzheimer, e que suscitaram o envio de uma carta de advertência da Food and Drug Administration à companhia farmacêutica suíça, não se verificam em Portugal. Uma confirmação dada pela Autoridade Nacional do Medicamento e dos Produtos de Saúde, que asseverou que os materiais informativos distribuídos aos profissionais de saúde portugueses são todos fabricados em Portugal.
Tal como o farmacia.com.pt noticiou na passada quinta-feira, dia 16, a FDA notificou a companhia farmacêutica devido a informações falsas sobre o Exelon (rivastigmina), que é actualmente o fármaco mais vendido para o tratamento da doença de Alzheimer, e que está disponível em mais de 70 países, entre os quais Portugal. A FDA acusou a Novartis de proclamar para o medicamento um maior índice de segurança do que aquele que foi efectivamente demonstrado nos ensaios clínicos realizados. Na nota, com data de dia 8, a entidade reguladora norte-americana teceu duras críticas ao laboratório, acusando-a de mentir aos doentes, e pediu que a verdade sobre a eficácia e os riscos inerentes à utilização daquele fármaco fosse reposta, estabelecendo como prazo o dia 22 deste mês para uma reacção da empresa suíça.
Nesse sentido, um porta-voz da Novartis reagiu prontamente ao comunicado, referindo que a empresa estaria a analisar o seu conteúdo e deveria responder, como solicitado, dentro de alguns dias, assegurando que seriam tomadas “as medidas necessárias para garantir que todos os materiais de promoção cumprem escrupulosamente as normas da FDA”. O farmacia.com.pt dava na altura conta de que o Exelon se encontra disponível no mercado farmacêutico internacional desde 1997 e que é actualmente comercializado em mais de 70 países, no tratamento de episódios de demência moderada em pacientes com Alzheimer. No nosso país foi introduzido em 1998 (com renovação em 2003). A um dia de expirar o prazo para uma reacção da Novartis, a entidade reguladora do sector do medicamento em Portugal esclareceu as irregularidades detectadas nos Estados Unidos não se verificam em Portugal, acrescentando que os materiais de promoção do Exelon distribuídos aos profissionais de saúde são produzidos e revistos no país.
Em representação do departamento médico da Novartis, Susana Marques reiterou, em declarações prestadas à Agência Lusa, que “os materiais promocionais distribuídos são produzidos em Portugal, rigorosamente revistos pelo departamentos médico e pelo dos assuntos regulamentares da empresa, e depois confrontados com os dados das revistas médicas e científicas”. Nessa medida, também o Infarmed frisou que, “até ao momento, nenhuma das situações mencionadas no documento emitido pela FDA foi detectada em Portugal”, e que “cabe a cada país a avaliação e monitorização da publicidade feita aos medicamentos, de acordo com a sua legislação”. Os reguladores nacionais adiantaram, no entanto, que acompanharão a situação e actuarão se e quando isso vier a revelar-se necessário”.
Carla Teixeira
Fonte: Agência Lusa, Rádio Comercial, Firstword, FDA, Bloomberg, Agência Efe
Occlutech pede invalidação da patente europeia da AGA
A Occlutech GmbH, fabricante alemã e líder europeia de dispositivos para oclusão coronária continua o braço-de-ferro com a AGA Medical. Agora, anunciou ter dado início ao processo de não violação de patente (de que foi acusada), onde solicita também a invalidação da patente europeia da AGA no Reino Unido.
Segundo noticia a PRNewswire, “devido à existência de arte anterior, a maioria das reivindicações já interpretadas nas patentes pela AGA Medical não foi aceite pelos revisores do Gabinete Europeu de Patentes no processo original de aprovação de patentes”, motivo este apontado como “mais do que justificativo e significativo” para a Occlutech solicitar a invalidação ao tribunal britânico.
De acordo com a informação avançada pela mesma fonte, a Occlutech terá ainda solicitado que o tribunal do Reino Unido declare que os dispositivos da fabricante alemã estão fora do âmbito da patente da AGA, “devido às diferenças fundamentais entre a patente e às configurações dos dispositivos da Occlutech.”
"Temos uma grande probabilidade de que a patente europeia da AGA seja invalidada por esta acção e devido aos próprios actos e argumentos da AGA perante o Gabinete Europeu de Patentes”, considerou Robert Moszner, representante da Occlutech, argumentando que a base tecnológica da Occlutech é bem distinta da AGA. "Os oclusores são novos e inovadores e são protegidos por uma sólida posição da propriedade intelectual”, frisou. O responsável da companhia alemã apontou, também, a "exclusividade" dos métodos e tecnologia da Occlutech, considerando que “são superiores e bastante diferentes de qualquer outro produto do mercado.”
A data da audiência ainda não foi marcada, mas a Occlutech está confiante na celeridade da decisão e no parecer favorável do tribunal no Reino Unido confirmando a não violação da patente o mais rápido possível e invalidando a única patente europeia concedida à AGA Medical.
Tratamento de doenças cardíacas
Os dispositivos de oclusão são para o tratamento de doenças cardíacas, incluindo os defeitos e anormalidades cardíacas estruturais, tais como Defeitos do Septo Atrial (DSA), ou Forame Oval Patente (FOP), de maneira minimamente invasiva e não cirúrgica.
Raquel Pacheco
Fonte: PRNewswire
Concursos públicos para abertura de farmácias
O Ministério da Saúde acaba de lançar concursos públicos para a abertura de farmácias no Centro Hospitalar de Coimbra e nos hospitais de Santa Maria, em Lisboa, e de Santo André, em Leiria, que serão das primeiras unidades de prestação de cuidados de saúde a dispor de estabelecimentos de dispensa de medicamentos abertos ao público no seu perímetro.
Tal como o farmacia.com.pt oportunamente noticiou – nas edições de 20 de Junho e 2 de Agosto –, há muito se sabia que o Hospital de Santa Maria, em Lisboa, seria um dos primeiros a estar dotado de uma farmácia comunitária no seu perímetro. O Ministério da Saúde confirmou agora essa informação, mas fez coincidir a abertura do concurso para aquela unidade com os concursos para duas outras, em Coimbra e Leiria. Assim, está a decorrer, até 11 de Setembro, o prazo para a apresentação de propostas no sentido da instalação de duas outras farmácias, no Centro Hospitalar de Coimbra e no Hospital de Santo André. A tutela anunciou igualmente que a abertura das propostas apresentadas deverá ser feita no dia seguinte, e que a escolha dos contemplados terá como principal critério a proposta economicamente mais vantajosa.
As farmácias comunitárias que venham a ser integradas no perímetro de hospitais terão horário de funcionamento permanente (24 horas por dia nos sete dias da semana), e no futuro poderão vir a dispensar medicamentos em unidose, prática ainda não legislada no nosso país (a não ser no ramo da Farmácia Hospitalar), mas que poderá ser autorizada mediante a publicação em «Diário da República» de uma portaria conjunta do Ministério da Saúde e do Ministério da Economia. Entretanto, os interessados em candidatar-se à instalação de uma das três farmácias comunitárias agora submetidas a concurso público poderão consultar o Decreto-Lei 235/2006 – que estabelece o regime de instalação, abertura e funcionamento das farmácias de dispensa de medicamentos ao público nos hospitais do Serviço Nacional de Saúde, e as condições da respectiva concessão –, que se encontra disponível também no site da Ordem dos Farmacêuticos, clicando na página online com o endereço www.ordemfarmaceuticos.pt.
Carla Teixeira
Fonte: Ordem dos Farmacêuticos, farmacia.com.pt
Despesa com medicamentos baixou
Os gastos com medicamentos no Serviço Nacional de Saúde baixaram 0,3 por cento no primeiro semestre deste ano, enquanto as despesas com material clínico sofreram uma quebra de 4,3 pontos percentuais, traduzindo-se numa poupança de cinco milhões de euros para os cofres do Estado. Dados positivos que, no entanto, não foram suficientes para melhorar o excedente do SNS, que caiu 65,9 por cento. São números da «Síntese de Execução Orçamental» da Direcção-Geral do Orçamento, a que o farmacia.com.pt teve acesso.
Nas páginas 12 e 13 da «Síntese de Execução Orçamental» da DGO relativa ao período compreendido entre Janeiro e Julho deste ano, e que foi divulgada há escassos dias, é traçado o quadro evolutivo do Sistema Nacional de Saúde ao longo dos primeiros seis meses que atesta que o excedente do Serviço Nacional de Saúde baixou, devido a um crescimento da despesa superior ao da receita, impulsionado pelos contratos-programa dos hospitais-empresa, que implicaram o acréscimo de 172 milhões de euros num total de 195 milhões de euros em despesas. À luz daqueles dados, o saldo positivo do SNS sofreu uma dura queda, na ordem dos 65,9 por cento, para os 97 milhões de euros. As receitas aumentaram 0,2 por cento e as despesas 5,1 por cento. A execução financeira do SNS no mês de Junho apresentou um saldo de 96,6 milhões de euros, contra 282,9 milhões em 2006.
A despesa com medicamentos foi um dos poucos items a registar melhoria no período em análise. Salienta-se também a redução de 0,9 pontos percentuais na categoria dos produtos vendidos por farmácias, bem como a descida de 0,4 por cento no que toca aos meios complementares de diagnóstico e terapêutica, rubrica que inclui os encargos de farmácias e convencionados da responsabilidade da Unidade Local de Saúde do Norte Alentejano. Nos outros serviços de saúde (hospitais EPE), o relatório destaca o aumento de 13,2 por cento nos valores referentes aos contratos-programa, sublinhando o facto de nos números se encontrar já refelectida a passagem de 12 unidades de prestação de cuidados de saúde à categoria de hospitais-empresa, bem como as revisões que foram efectuadas a contratos-programa de alguns estabelecimentos.
Carla Teixeira
Fonte: «Síntese da Execução Orçamental» da Direcção Geral do Orçamento, Ordem dos Farmacêuticos, Agência Lusa
Anvisa informatiza fiscalização de medicamentos
 A Agência Nacional de Vigilância Sanitária (Anvisa), entidade reguladora do sector do medicamento no Brasil, está a preparar a entrada em vigor de um sistema nacional de gestão dos produtos controlados (sujeitos a normas especiais, definidas no âmbito da Portaria SVS/MS nº 344, de 12 de maio de 1998). Assim, e pondo termo à situação actual, em que as farmácias registam em livros a dispensa daqueles medicamentos, a nova medida levará à informatização de todos os dados, com actualização imediata nos serviços da Anvisa.
A Agência Nacional de Vigilância Sanitária (Anvisa), entidade reguladora do sector do medicamento no Brasil, está a preparar a entrada em vigor de um sistema nacional de gestão dos produtos controlados (sujeitos a normas especiais, definidas no âmbito da Portaria SVS/MS nº 344, de 12 de maio de 1998). Assim, e pondo termo à situação actual, em que as farmácias registam em livros a dispensa daqueles medicamentos, a nova medida levará à informatização de todos os dados, com actualização imediata nos serviços da Anvisa.Com a entrada em funcionamento do novo esquema de tratamento de dados, assim que um determinado medicamento sujeito a controlo especial for dispensado numa farmácia ou estabelecimento de venda autorizado, o farmacêutico dará de imediato baixo daquele produto no sistema informático, sendo essa informação, por conseguinte, imediatamente actualizada na rede de informação da autoridade nacional e dos pontos de vigilância do mercado a nível municipal e estatal. Na lista dos medicamentos controlados no Brasil há fármacos antidepressivos e moderadores de apetite. A Anvisa prevê que o novo sistema esteja totalmente operacional em todo o país no prazo máximo de um ano, estimando-se que possa arrancar de forma progressiva nos vários Estados, com natural primazia para a capital, Brasília. De acordo com o presidente do Conselho Regional de Farmácias do Distrito Federal, Hélio Araújo, que apoiou a medida, “a resolução da Anvisa vai restringir ao máximo a venda indiscriminada dos medicamentos sem receita”.
Carla Teixeira
Fonte: Agência Brasil, JB Online, Redegoverno.gov.br
segunda-feira, 20 de agosto de 2007
Penicilina lidera reacções adversas
 FMUP estudou prevalência das RAM e concluiu que mulheres são mais susceptíveis
FMUP estudou prevalência das RAM e concluiu que mulheres são mais susceptíveisUma investigação realizada pela Faculdade de Medicina da Universidade do Porto (FMUP) intitulada «Prevalência das reacções adversas a medicamentos» revelou que a penicilina foi o medicamento mais apontado pelas pessoas inquiridas. Outro resultado permitiu ainda concluir que as mulheres são, significativamente, mais susceptíveis de apresentarem os “sintomas adversos”.
De acordo com o estudo feito por marcação telefónica aleatória à população adulta do Porto - e que o farmacia.com.pt teve acesso - o fármaco mais apontado no quadro das reacções adversas a medicamentos (RAM) foi a penicilina (47,4%).
Segundo a FMUP, foram realizados 200 contactos telefónicos, dos quais 103 indivíduos (51,5%) responderam ao questionário. A idade dos participantes varia entre 18 e 85 anos e a maioria são mulheres (74,5%). No contexto das adversidades, os inquiridos indicaram ainda outros antibióticos (10,5%) e outros medicamentos não especificados (26,3%). Dos 103 participantes, 9,7% realizaram algum tipo de teste para confirmar a reacção.
“Podemos afirmar com 95% de certeza que, entre as percentagens de 13 a 29%, os indivíduos acreditam ser alérgicos a medicamentos, e podemos afirmar ainda com 95% de certeza que entre as percentagens de 11 a 26% os indivíduos têm a confirmação médica de alergia a medicamentos”, asseveraram os investigadores da FMUP.
Outro resultado sugere que as mulheres são, significativamente, mais susceptíveis de apresentarem RAM (78,9%). "Entre 10% e 29% podemos afirmar com 95% de certeza que os indivíduos do sexo feminino apresentam hipersensibilidade a medicamentos", concluiram os cientistas da FMUP.
Raquel Pacheco
Fonte: Estudo da FMUP
Alergia à penicilina mais comum nas mulheres
Estudo norte-americano sugere relação entre antibiótico de Fleming e sexo do doente
A alergia à penicilina é mais comum nas mulheres. A conclusão saiu de um estudo norte-americano publicado na revista «Annals of Allergy, Asthma & Immunology». O resultado dos testes cutâneos efectuados revelou que a intolerância àquele antibiótico esteve 3,6 vezes mais presente no sexo feminino, comparativamente, com o sexo masculino.
Se a alergia à penicilina está relacionada com o sexo do doente - foi a “incerteza” que catapultou a investigação conduzida por uma equipa de cientistas da Mayo Clinic College of Medicine, nos Estados Unidos.
Partiram de duas certezas: de que alergia a medicamentos é uma condição de suprema importância pelas diversas repercussões clínicas que podem espoletar, e que os antibióticos (penicilinas, sulfonamidas) e os anti-inflamatórios (ácido acetil salicílico - AAS), são os fármacos que mais, comumente, se relacionam a um quadro alérgico.
Descobriram que a penicilina – primeiro antibiótico natural derivado de um fungo, o bolor do pão Penicillium chrysogenum (ou P. notatum) – desencadeia mais alergias nas mulheres: 83% dos casos analisados eram do sexo feminino e os 17% restantes eram do sexo masculino.
Segundo informa a «Annals of Allergy, Asthma & Immunology», o estudo envolveu 1.759 participantes com histórico de alergia àquele antibiótico, mas apenas 4% dos doentes avaliados apresentavam teste cutâneo confirmatório de alergia à penicilina, positivo.
Como resultado conclusivo, os investigadores da Mayo Clinic, apontaram o facto de a alergia ter estado 3,6 vezes mais presente no sexo feminino, em comparação com o sexo masculino.
A Penicilina foi descoberta em 22 de Setembro de 1928, pelo médico e bacteriologista escocês Alexander Fleming e está disponível como fármaco desde 1941, sendo o primeiro antibiótico a ser utilizado com sucesso. O nome penicilina é usado também para outros antibióticos relacionados.
Sintomas mais comuns
A alergia à penicilina manifesta-se de forma imprevisível e variada, desde sintomas discretos até quadros potencialmente fatais, nomeadamente: Erupção na pele - caracterizada pelo aparecimento de “pintinhas” ou lesões rendilhadas e avermelhadas na pele.; Comichão intensa, rubor, urticária; Inchaço dos lábios, pálpebras e face; Casos graves poderão evoluir com envolvimento de múltiplos órgãos e sistemas do organismo, manifestando-se com sintomas graves e variados: asma (broncoespasmo), rinite, sintomas gastro-intestinais, alterações cardiovasculares,etc.
Raquel Pacheco
Fonte: «Annals of Allergy, Asthma & Immunology» (Julho)/Prontuário
FDA aprovou Reclast da Novartis
A companhia farmacêutica suíça Novartis anunciou a aprovação, por parte da Food and Drug Administration (FDA), do seu pedido de introdução no mercado farmacêutico norte-americano do Reclast, medicamento contra a osteoporose e o enfraquecimento ósseo que só deverá ser administrado uma vez por ano em mulheres que já tenham entrado na menopausa. Uma vantagem face aos tratamentos convencionais, que exigem aplicação semanal ou mensal...
De acordo com as informações avançadas pela companhia farmacêutica na sua página online, a aprovação de entrada no mercado da injecção de Reclast (ácido zoledrónico) é uma boa notícia, que poderá ajudar cerca de oito milhões de mulheres à escala mundial. A autorização expressa pela entidade reguladora norte-americana surge no seguimento dos bons resultados de um ensaio clínico do medicamento em cerca de 7700 mulheres, tendo a Novartis realçado o facto de este ser um fármaco inovador, que vem libertar as doentes de uma submissão semanal ou mensal aos tratamentos. “O facto de o Reclast ser altamente eficaz e de poder ser administrado uma vez por ano representa um passo muito grande em termos de terapia para a osteoporose”, salientou Felicia Cosman, que é professora de Medicina Clínica da Universidade de Colúmbia, em Nova Iorque, para quem a principal vantagem da injecção é a de, “pela primeira vez, podermos garantir às mulheres um ano completo de tratamento necessário à protecção dos seus ossos”.
 A Novartis anunciou igualmente que aguarda agora aprovação da Agência Europeia de Medicamentos (EMEA) para introduzir a nova terapia na Europa, onde deverá adoptar a designação comercial de Aclasta. De acordo com a empresa farmacêutica, é de esperar que essa autorização possa ser concedida ainda no decurso deste ano. Na base desta decisão da FDA estão os resultados de um estudo financiado pelo laboratório, que dão conta de uma redução de 70 por cento na ocorrência de fracturas espinhais em 7.700 mulheres que tomaram o Reclast. A investigação demonstrou que cerca de 11 por cento de pacientes tratadas com um placebo sofreram fracturas no intervalo de três anos, mas entre as que receberam o Reclast só 3,3 por cento sofreram do problema.
A Novartis anunciou igualmente que aguarda agora aprovação da Agência Europeia de Medicamentos (EMEA) para introduzir a nova terapia na Europa, onde deverá adoptar a designação comercial de Aclasta. De acordo com a empresa farmacêutica, é de esperar que essa autorização possa ser concedida ainda no decurso deste ano. Na base desta decisão da FDA estão os resultados de um estudo financiado pelo laboratório, que dão conta de uma redução de 70 por cento na ocorrência de fracturas espinhais em 7.700 mulheres que tomaram o Reclast. A investigação demonstrou que cerca de 11 por cento de pacientes tratadas com um placebo sofreram fracturas no intervalo de três anos, mas entre as que receberam o Reclast só 3,3 por cento sofreram do problema.Carla Teixeira
Fonte: Novartis, FDA, Firstword, Agência Efe
FDA decide manter Avandia no mercado
Parece sanada a polémica em torno do Avandia (maleato de rosiglitazona) nos Estados Unidos. A Food and Drug Administration, entidade que regula o sector do medicamento naquele país, atendeu a recomendação feita há poucos dias por um painel de peritos, e decidiu manter no mercado o fármaco da GlaxoSmithKline. Tal como o farmacia.com.pt tem vindo a noticiar, sobre o Avandia cai a acusação de potenciar maior risco de doença cardíaca nos doentes diabéticos. A FDA reconhece o risco, mas frisa que os benefícios são maiores, obrigando apenas o laboratório a alterar a rotulagem.
Não obstante o elevado número de estudos que davam conta da maior prevalência de problemas cardiovasculares nos doentes diabéticos medicados com o Avandia, a FDA entendeu dar ouvidos à comissão de especialistas que há poucos dias recomendou a manutenção da disponibilização do medicamento nos Estados Unidos. Depois de ouvir os peritos, a entidade reguladora votou a favor da permanência do Avandia, o fármaco que desde o seu lançamento, em 1999, já terá sido administrado a cerca de seis milhões de pessoas em todo o mundo, tendo sido, no ano passado, o tratamento para a diabetes mais bem sucedido à escala global, com um volume de vendas que ultrapassou os 2,4 mil milhões de euros. Está também disponível em Portugal.
Carla Teixeira
Fonte: «Público», Saúde na Internet, farmacia.com.pt
Quando e como fazer a medicação oral?
 A ideia generalizada de que os medicamentos administrados por via oral devem sempre ser tomados com o estômago cheio está profundamente errada. Embora haja fármacos cuja acção é potenciada nesse cenário, por ser nele que ocorre a absorção máxima, ou que afectam menos o aparelho digestivo se ingeridos sem a presença de alimentos, há outros casos em que essa atitude pode ser muito prejudicial para o doente. O mesmo se passa com os horários de administração do tratamento, que podem ter uma importância crucial ou pouco significativa.
A ideia generalizada de que os medicamentos administrados por via oral devem sempre ser tomados com o estômago cheio está profundamente errada. Embora haja fármacos cuja acção é potenciada nesse cenário, por ser nele que ocorre a absorção máxima, ou que afectam menos o aparelho digestivo se ingeridos sem a presença de alimentos, há outros casos em que essa atitude pode ser muito prejudicial para o doente. O mesmo se passa com os horários de administração do tratamento, que podem ter uma importância crucial ou pouco significativa.A leitura das indicações terapêuticas constantes no folheto incluso é, também por isso, fundamental. Nela deverão ser explicadas as circunstâncias em que cada medicamento deve ser tomado, e os cenários em que a sua acção máxima é espoletada. Em alguns o efeito é melhorado se forem tomados antes das refeições, porque são inactivados pelos alimentos, noutros se forem tomados em seguida, porque nessa altura o estômago está protegido contra possíveis efeitos irritantes. A anotação dos horários e das condições em que determinados medicamentos devem ser administrados, designadamente quando o mesmo doente está a ser submetido a vários compostos químicos, poderá ser útil para melhor coordenar a toma e potenciar os seus efeitos positivos. No caso da azitromicina, por exemplo, a administração do antibiótico depois de uma refeição fará com que o seu efeito seja retardado.
Há também o risco de determinadas substâncias interagirem entre si ou com alimentos com que sejam ingeridas, adulterando o que deveria ser o efeito de cada uma delas no organismo do paciente. É o caso do leite, que muitas vezes se pensa poder ser útil para proteger o estômago da acção de um medicamento com características mais agressivas para aquele órgão, mas que pode, pelo contrário, inibir a acção de fármacos como, por exemplo, a tetraciclina, que perde eficácia se administrada com leite. A toma conjunta de antibióticos derivados das penicilinas (amoxicilina e ampicilina) e contraceptivos também é incorrecta, podendo comprometer a protecção do anticoncepcional, abrindo caminho a uma gravidez indesejada, e nos casos mais graves pode mesmo provocar hemorragias vaginais mais ou menos intensas.
Um simples descongestionante nasal pode igualmente causar problemas graves se for associado a um antiespasmódico, porque alguns aumentam o ritmo cardíaco e podem causar paragens do coração. Os tratamentos contra a hipertensão também não podem ser associados com anti-inflamatórios, sob pena de terem a sua eficácia reduzida. É o caso do Captopril, por exemplo, mas também de muitos outros medicamentos. Também a toma simultânea de antibióticos e diuréticos ou anti-ácidos pode potenciar uma perda de até 30 por cento no processo de absorção do antibiótico, reduzindo a sua eficácia. O papel do farmacêutico passa também por prestar estes esclarecimentos aos doentes no acto de aquisição dos seus medicamentos.
Carla Teixeira
Fonte: «A Gazeta»
Identificada proteína chave que intervém na pigmentação da pele
A equipa de investigadores, dirigida por Thierry Passeron, descobriu que a proteína SOX9 está presente nos melanócitos normais. Quando as células da pele são expostas aos raios ultravioleta B (UVB), a proteína SOX9 activa uma cadeia de proteínas que aumenta os níveis de melanina, tornando assim a pele mais escura.
O papel da SOX9 na pigmentação já tinha sido abordado em anteriores estudos com pacientes com vitíligo, que têm anticorpos contra a proteína SOX9, o que possivelmente provoca a perda de pigmento nestas pessoas. O vitíligo é uma doença em que a perda de melanócitos produz manchas lisas e brancas na pele. A compreensão da função da SOX9 nas células da pele poderá conduzir a tratamentos para o vitíligo e outros transtornos da pigmentação.
Os investigadores também demonstraram que a proteína relacionada com o agouti (ASP, sigla em inglês), um factor conhecido por diminuir a pigmentação, actua ao reduzir o nível da SOX9. Antes deste estudo, a proteína SOX9 era conhecida pelo seu papel no determinismo sexual e em transtornos do esqueleto, pela sua presença nas células produtoras de cartilagem e pelo seu papel na manutenção dos níveis de colagénio II.
Isabel Marques
Fontes: www.azprensa.com, www.pnas.org, www.manualmerck.net
domingo, 19 de agosto de 2007
Fumadores têm quatro vezes mais probabilidade de desenvolver uma doença ocular grave
Os investigadores observaram 2.454 australianos a partir dos 49 anos, de forma a estudar a ligação entre o tabagismo e a incidência da DMI, num período de dez anos, assim como possíveis associações entre o tabagismo e outros factores comuns de risco. Os participantes no estudo tiveram de responder a um questionário sobre a dieta alimentar, os hábitos como fumador, e as retinas foram fotografadas em exames de seguimento aos cinco e dez anos, além da medição do índice de massa corporal (IMC) e da pressão arterial.
Os dados do estudo demonstraram que os fumadores tinham quatro vezes mais probabilidade de desenvolver DMI e os antigos fumadores eram três vezes mais propensos a sofrer de atrofia geográfica, uma forma avançada da doença, em comparação com as pessoas que nunca fumaram. As conclusões finais revelam que fumar aumenta consideravelmente os riscos de incidência da DMI a longo prazo, possivelmente com um maior efeito nas pessoas com níveis baixos de lipoproteínas de elevada densidade (HDL), ou bom colesterol, com um rácio elevado de colesterol total para o HDL-colesterol e que consomem pouco peixe.
Para informações detalhadas sobre a DMI é possível consultar no farmacia.com.pt o artigo “DMI: Espreitar pela sombra do mundo”, publicado a 22 de Junho de 2007.
Isabel Marques
Fontes: www.azprensa.com, http://archopht.ama-assn.org
Composto promissor para a fibrose cística em desenvolvimento
As companhias iniciaram um acordo exclusivo de licenciamento e de co-desenvolvimento para o P-680 que garante os direitos de comercialização mundial do fármaco à Gilead, para o tratamento de doenças pulmonares, incluindo a fibrose cística e a doença pulmonar obstrutiva crónica (DPOC). As companhias irão ainda colaborar num programa de investigação para identificar outros fármacos experimentais promissores baseados em bloqueadores do canal de sódio epitelial.
Os inibidores do canal de sódio epitelial são agentes terapêuticos únicos que estimulam e mantêm a hidratação nas superfícies mucosas do corpo, incluindo as dos pulmões, boca, nariz, olhos e tracto gastrointestinal. A restituição da hidratação das superfícies mucosas das vias respiratórias vai de encontro ao problema fundamental que produz infecções, tanto nas formas adquiridas como nas genéticas da doença pulmonar crónica, incluindo a DPOC e a FC. O P-680 está delineado para diminuir o desenvolvimento de muco espesso e pegajoso nos pulmões de pacientes com fibrose cística, o que origina frequentemente infecções graves que reduzem o funcionamento dos pulmões e provocam danos irreversíveis nos pulmões.
Uma condição comum nos pacientes com fibrose cística é a absorção excessiva de sódio pelas células afectadas, tais como as que cobrem os pulmões, agravada pela incapacidade do cloreto em sair rapidamente dessas mesmas células. É este efeito de rede de ambas as acções que faz aumentar as secreções espessas persistentes, que por fim alimentam a bactéria e criam a destruição dos pulmões. Os compostos como o P-680 tentam remediar esta condição através da diminuição da absorção excessiva de sódio das células da fibrose cística.
Segundo os termos do acordo, a Gilead irá fazer um pagamento adiantado de 5 milhões de dólares pela licença e irá fazer um investimento adicional na Parion de mais 5 milhões de dólares. A Gilead irá ainda fornecer fundos para a investigação e irá efectuar pagamentos quando foram atingidos certos objectivos, resultando o acordo num valor potencial de aproximadamente 146 milhões de dólares.
Isabel Marques
Fontes: www.medicalnewstoday.com, www.gilead.com
Bebés em risco de overdose de morfina
A administração de codeína, substância presente em vários analgésicos, que é comum em mulheres que acabaram de dar à luz, para atenuar as dores subsequentes ao parto, pode ser perigosa para os bebés, se estiverem a ser amamentados pela mãe. Segundo uma nota divulgada no site da Food and Drug Administration, a amamentação de bebés cujas mães ingeriram codeína pode colocá-los em risco de overdose de morfina, que é fabricada no fígado das progenitoras e se transmite por aquela via.
 A codeína é um fármaco alcalóide do grupo dos opiáceos (é encontrada no ópio com concentrações que variam entre os 0,5 e os 2,5 por cento), normalmente utilizado para o tratamento de sintomatologia como dores moderadas, diarreias e tosses de origem não bacteriana, em particular se são desnecessárias e prolongadas, como acontece com as tosses provocadas pelo cancro do pulmão. Agonista fraco dos receptores opióides no organismo humano, obtém o efeito antitússico pela pressão do centro nervoso cerebral de controlo do mecanismo da tosse, enquanto o efeito analgésico advém do mimetismo, nos mesmos receptores opióides, da acção da acção das endorfinas endógenas que controlam a dor, e o efeito obstipante resulta da acção exercida nos receptores opióides dos neurónios do intestino.
A codeína é um fármaco alcalóide do grupo dos opiáceos (é encontrada no ópio com concentrações que variam entre os 0,5 e os 2,5 por cento), normalmente utilizado para o tratamento de sintomatologia como dores moderadas, diarreias e tosses de origem não bacteriana, em particular se são desnecessárias e prolongadas, como acontece com as tosses provocadas pelo cancro do pulmão. Agonista fraco dos receptores opióides no organismo humano, obtém o efeito antitússico pela pressão do centro nervoso cerebral de controlo do mecanismo da tosse, enquanto o efeito analgésico advém do mimetismo, nos mesmos receptores opióides, da acção da acção das endorfinas endógenas que controlam a dor, e o efeito obstipante resulta da acção exercida nos receptores opióides dos neurónios do intestino.Porque é parcialmente convertida em morfina no fígado, a codeína pode ser transmitida verticalmente, entre mãe e filho, na amamentação. De acordo com o último comunicado da entidade reguladora do sector do medicamento norte-americano acerca da codeína, ela está presente em muitos medicamentos, alguns não sujeitos a receita médica, que na dissolução no organismo libertam morfina. Nessa medida, e não obstante o facto de serem raros os casos de overdose de morfina em crianças que são amamentadas com leite materno, esse risco existe e as consequências são graves, pelo que os reguladores norte-americanos recomendam aos médicos “que receitem às mães que amamentam doses mais fracas de codeína e por períodos muito curtos”.
Paralelamente a Food and Drug Administration exortou as companhias farmacêuticas a colocar nas embalagens dos medicamentos que possam representar aquele risco para as mães e os seus bebés uma chamada de atenção nesse sentido. Às progenitoras é ainda recomendada a vigilância atenta e permanente dos seus filhos, e a acção imediata no caso de eles evidenciarem sinais de overdose de morfina como são a sonolência, as dificuldades em respirar ou a falta de energia.
Carla Teixeira
Fonte: FDA, Wikipedia
sábado, 18 de agosto de 2007
Vacina contra o cancro da mama revela-se segura
 Os resultados de um ensaio clínico de fase I da Neuvenge, vacina experimental contra o cancro da mama desenvolvida pela Dendreon Corporation, publicados na última edição do «Journal of Clinical Oncology», aferiram a segurança e eficácia da imunização. Num conjunto de 18 mulheres com neoplasia mamária em estado muito avançado houve uma paciente que desenvolveu resposta parcial ao tratamento durante seis meses, com uma redução do tumor, enquanto outras três conseguiram estabilizar a evolução da doença ao longo de mais de um ano.
Os resultados de um ensaio clínico de fase I da Neuvenge, vacina experimental contra o cancro da mama desenvolvida pela Dendreon Corporation, publicados na última edição do «Journal of Clinical Oncology», aferiram a segurança e eficácia da imunização. Num conjunto de 18 mulheres com neoplasia mamária em estado muito avançado houve uma paciente que desenvolveu resposta parcial ao tratamento durante seis meses, com uma redução do tumor, enquanto outras três conseguiram estabilizar a evolução da doença ao longo de mais de um ano.De acordo com um comunicado emitido pela empresa farmacêutica responsável pelo medicamento, o ensaio clínico de fase I da Neuvenge surge vários anos depois de ter arrancado uma série de testes com a Provenge, que está já a ser analisada no âmbito de um ensaio clínico de fase III. Concebida mediante a utilização de células imunes das próprias doentes, a nova vacina “foi bem tolerada” pela generalidade das doentes a que foi administrada, segundo informações avançadas por John Park, da Universidade da Califórnia, nos Estados Unidos, que conduziu o estudo. O especialista considerou muito positivo o facto de pelo menos uma doente ter sido ajudada, referindo a recidiva sofrida pelo tumor, e a circunstância de, em três outras doentes, a evolução do cancro da mama ter também sido travada durante cerca de um ano. A vacina é meramente terapêutica, o que significa que só poderá ser administrada para estimular uma resposta imunológica da parte de doentes já confirmadas, não tendo aplicação profiláctica. Funciona através da remoção das células T do organismo das mulheres, para as “treinar” na tarefa de reconhecimento da tipologia do cancro da mama, e numa nova inserção nas pacientes.
Carla Teixeira
Fonte: Dendreon, PSA Rising, Agência Reuters, «Sol», Angola Press
REPORTAGEM
Pílula anticoncepcional completou 47 anos
O conservadorismo da sociedade em relação ao comportamento sexual, que até 1960 tinha como grande aliada a associação exclusiva e quase imediata da ideia de sexo ao conceito de reprodução, começou a cair por terra há exactamente 47 anos. Foi no dia 18 de Agosto de 1960 que, dando seguimento a uma aprovação concedida em Maio do mesmo ano pela Food and Drug Administration (FDA), era introduzido no mercado farmacêutico norte-americano, com a chancela da Searle Drug Company, o primeiro contraceptivo oral. Tinha a designação comercial de Enovid-10, mas rapidamente assumiu, em todo o mundo, um nome muito mais simples. A “pílula” alavancou uma verdadeira revolução à escala global...
 “Um dia histórico e um tremendo passo à frente”. Foi assim que, no ano seguinte (a 1 de Junho de 1961), a revista alemã «Der Stern» fez manchete com a notícia da introdução no mercado germânico, com a designação comercial de Anovlar – uns comprimidos verdes cujas indicações terapêuticas no folheto incluso referiam a sua utilidade “para aliviar os sintomas desagradáveis da menstruação” – de um fármaco que, diversamente de tudo o que tinha acontecido até àquela altura, foi aprovado para um efeito que não contemplava a luta contra qualquer sintoma de doença. A pílula libertou a sexualidade de uma série de angústias, permitindo às mulheres de todo o mundo conceber a ideia de que poderiam ter sexo sem correr o risco de engravidar, rompendo com a visão anterior de que as relações sexuais só poderiam ter como finalidade a procriação.
“Um dia histórico e um tremendo passo à frente”. Foi assim que, no ano seguinte (a 1 de Junho de 1961), a revista alemã «Der Stern» fez manchete com a notícia da introdução no mercado germânico, com a designação comercial de Anovlar – uns comprimidos verdes cujas indicações terapêuticas no folheto incluso referiam a sua utilidade “para aliviar os sintomas desagradáveis da menstruação” – de um fármaco que, diversamente de tudo o que tinha acontecido até àquela altura, foi aprovado para um efeito que não contemplava a luta contra qualquer sintoma de doença. A pílula libertou a sexualidade de uma série de angústias, permitindo às mulheres de todo o mundo conceber a ideia de que poderiam ter sexo sem correr o risco de engravidar, rompendo com a visão anterior de que as relações sexuais só poderiam ter como finalidade a procriação.A contracepção oral começou a ser moda em todo o mundo – chegou a Portugal e ao Brasil em 1962 –, gerando enormes lucros para a indústria farmacêutica, ao mesmo tempo que semeava nas tradicionalmente dominantes mentes masculinas o receio da infidelidade das esposas e namoradas. O momento alto da pílula veio a seguir, com o Woodstock e os hippies, a efervecência do movimento estudantil e o avanço do feminismo, mas foi preciso pouco tempo para que começassem a circular as notícias relativas aos seus efeitos colaterais, que há cerca de quatro dezenas de anos incluíam o perigo de trombose. Os laboratórios prosseguiram os estudos, e anos depois desenvolveram novas soluções de contracepção, como a mini e a micropílula, com dosagens hormonais mais baixas, e mais recentemente a pílula do dia seguinte, o adesivo contraceptivo ou o implante de hormonas.
História e evolução
A história da pílula anticoncepcional tem início ainda nos anos 50, na sequência de um desafio lançado pela feminista Margaret Sanger e pela milionária Katherine McCormick à comunidade científica, no sentido da criação de um método contra a gravidez que fosse fácil de usar, mais cómodo do que os existentes, eficiente e barato. O investigador Gregory Pincus aceitou o repto, mas durante anos teve de trabalhar às escondidas, uma vez que os contraceptivos estavam oficialmente proibidos nos Estados Unidos, situação que se prolongou até à década seguinte. Alegando que estava a tentar responder à necessidade de aliviar os sintomas menos cómodos da menstruação, demorou cinco anos a desenvolver a pílula que em 1960 foi baptizada como Enovid-10.
Actualmente as pílulas de baixa dosagem são muito mais seguras do que as suas congéneres mais antigas, mas há estudos que apontam para um risco elevado de trombose venose profunda às chamadas pílulas de terceira geração, apesar de o perigo ser muito reduzido em mulheres saudáveis, não fumadoras e que tenham menos de 35 anos, aumentando significativamente nas mulheres mais velhas e que fumem, designadamente no que diz respeito à incidência de doenças ligadas ao aparelho circulatório.
Carla Teixeira
Fonte: «Deutche Welle», «Século XXI», SIC, «British Medical Journal», Bibliomed, «Archives of Internal Medicine», JAMA
Organizações farmacêuticas e de saúde americanas lançam plataforma de resposta a desastres
Organizações de saúde americanas, envolvidas no fabrico, distribuição e preparação de produtos farmacêuticos, anunciaram a criação do Rx Response, um programa desenhado para ajudar no suporte da entrega continuada de medicamentos durante uma situação grave de emergência de saúde pública.
O Rx Response baseia-se no reconhecimento, por parte das organizações, de que o acesso a medicamentos durante períodos de graves emergências no campo da saúde pública requerem um esforço abrangente e uma comunicação próxima entre os diversos accionistas do sector envolvidos, tanto públicos como privados.
O presidente da Pharmaceutical Research and Manufacturers of America (PhRMA), Billy Tauzin, afirmou que, durante uma catástrofe, é vital que os sistemas estejam preparados para dar assistência através da entrega continuada de medicamentos aos hospitais, aos fornecedores de cuidados médicos e aos pacientes. O Rx Response é uma parceria dedicada a dar assistência através da entrega de medicamentos cruciais aos pacientes cuja saúde esteja ameaçada durante uma situação de crise.
O programa Rx Response inclui as indústrias farmacêutica e biotecnológica, assim como as companhias de distribuição, farmácias e hospitais, ou seja, todos os que têm um papel na distribuição de medicamentos aos pacientes, sendo parceiros deste programa a American Hospital Association, American Red Cross, Biotechnology Industry Organization, Healthcare Distribution Management Association, National Association of Chain Drug Stores, National Community Pharmacists Association e a Pharmaceutical Research and Manufacturers of America.
No passado, quando a cadeia de fornecimentos de produtos farmacêuticos era interrompida, não existia nenhum fórum onde os fornecedores podiam reunir e partilhar informação. Agora, o Rx Response irá ajudar no apoio à partilha de informação entre os parceiros.
O programa será activado quando for necessário responder a graves emergências no domínio da saúde pública, quando os planos de assistência de emergência e programas de serviço existentes forem interrompidos, e na ajuda a assistir organizações parceiras nas suas actividades individuais de resposta.
Isabel Marques
Fontes: www.medicalnewstoday.com, www.rxresponse.org
Novo sistema será apresentado brevemente
 A Ordem dos Farmacêuticos conta apresentar brevemente o novo sistema para revalidação da carteira profissional, uma das grandes bandeiras da campanha de Irene Silveira ao cargo de bastonária da OF, conforme disse ao farmacia.com.pt numa entrevista publicada a 14 de Junho, uma semana antes das eleições que a consagraram como representante máxima da classe em Portugal.
A Ordem dos Farmacêuticos conta apresentar brevemente o novo sistema para revalidação da carteira profissional, uma das grandes bandeiras da campanha de Irene Silveira ao cargo de bastonária da OF, conforme disse ao farmacia.com.pt numa entrevista publicada a 14 de Junho, uma semana antes das eleições que a consagraram como representante máxima da classe em Portugal.Num comunicado disponível no site da Ordem dos Farmacêuticos, Irene Silveira dá conta da intenção de, a breve trecho, anunciar as novas regras de revalidação da carteira profissional, enfatizando precisamente a ideia de que essa medida foi uma das apostas centrais da sua candidatura, e salvaguardando que a formação contínua dos profissionais de farmácia, tendo em conta a evolução constante do sector, é indispensável ao bom exercício daquelas funções, bem como ao reforço da empregabilidade e da competitividade das empresas farmacêuticas. Afirma a bastonária que “o farmacêutico não pode deixar de investir na sua aprendizagem ao longo da vida, e consequentemente na sua valorização e qualificação”, e que à OF, como entidade reguladora, “cabe garantir que o desempenho profissional se pauta por elevados compromissos ético-deontológicos, assentes na prática suportada pela evidência técnico-científica”.
Lembrando que os actuais corpos sociais da Ordem apresentaram no decurso da sua campanha “um programa alicerçado na mudança”, e que entre as mudanças propostas figurava a da revisão da metodologia de creditação e de revalidação da carteira profissional, Irene Silveira assevera que a nova direcção nacional da OF “desencadeará brevemente o processo de revisão e reformulação da estratégia de intervenção nesta matéria, que naturalmente implicará um período de reflexão e de implementação de novas medidas”. Por esse motivo, explica, “o sistema de creditação e revalidação da carteira profissional encontra-se suspenso, de forma a promover a sua adequada revisão”, avisando contudo que a Ordem continuará a receber os processos que os profissionais entendam enviar-lhe, mesmo durante o período de suspensão.
Na entrevista concedida em Junho ao farmacia.com.pt, e questionada sobre o que importa mudar no sistema de revalidação da carteira profissional, a candidata referia que “importa mudar tudo”, acrescentando que desde 1983 faz parte de um grupo de formadores de farmacêuticos, e que também nessa qualidade estava já “totalmente de acordo com a necessidade de formação”, porque “as pessoas que saem das universidades estão normalmente muito bem preparadas”, mas o ritmo de evolução da Ciência é muito acelerado. “Preconizo que a formação contínua é muito importante, mas não, de modo algum, a frequência de acções de formação que atribuem créditos de modo arbitrário”, justificou.
Afirmava então a responsável que “é preciso valorizar a experiência diária dos farmacêuticos. As pessoas têm de saber que competências têm de desenvolver e voluntariamente decidir adquirir competências. Não pode haver obrigatoriedade, por uma questão de créditos, de os profissionais frequentarem certas acções de formação, que nem sempre são as que melhor servem os seus interesses e os interesses dos doentes. A revalidação da carteira profissional não poderá estar veiculada ao actual sistema. A qualificação é uma das minhas prioridades, mas não da forma que actualmente está considerada. É minha prioridade absoluta reformular o actual sistema, porque esta plêiade de cursos de formação não traz nada de positivo”. O comunicado agora divulgado no site da OF estabelece para breve o arranque dessa mudança.
Carla Teixeira
Fonte: Ordem dos Farmacêuticos, entrevista à candidata em Junho
Rastreios gratuitos à saúde dos pés
 Vai estar em marcha itinerante pelas farmácias uma campanha nacional gizada pela Associação Portuguesa de Podologia, em colaboração com o novo medicamento da Novartis para o pé-de-atleta Lamisil 1 (terbinafina). A iniciativa consiste numa série de rastreios gratuitos que têm como objectivo aferir e ajudar a manter a boa forma dos pés dos cidadãos portugueses e promover o despiste precoce das doenças podológicas como a tinea pedis, infecção fúngica que afecta mais de dois milhões de portugueses.
Vai estar em marcha itinerante pelas farmácias uma campanha nacional gizada pela Associação Portuguesa de Podologia, em colaboração com o novo medicamento da Novartis para o pé-de-atleta Lamisil 1 (terbinafina). A iniciativa consiste numa série de rastreios gratuitos que têm como objectivo aferir e ajudar a manter a boa forma dos pés dos cidadãos portugueses e promover o despiste precoce das doenças podológicas como a tinea pedis, infecção fúngica que afecta mais de dois milhões de portugueses.Apresentado publicamente em Abril passado pela Novartis Consumer Health no Porto, o Lamisil 1 é o primeiro tratamento que, numa única aplicação tópica, combate os efeitos do pé-de-atleta. Não sujeito a receita médica, está disponível no mercado farmacêutico nacional como solução cutânea, numa dosagem de 10 mg/g, e será protagonista das várias sessões da campanha que a Associação Portuguesa de Podologia vai levar a cabo em todo o território nacional. Ao longo deste mês e do seguinte, a iniciativa deverá percorrer inúmeras farmácias, realizando rastreios gratuitos a todos os interessados em saber como vai a saúde dos seus pés, que no Verão tendem sempre a ser maltratados pela praia, pelos banhos frequentes e pelo maior contacto com as impurezas no ar. Com o objectivo de “alertar os portugueses para a sáude dos pés”, a campanha arranca no dia 31, e visitará mais de 40 farmácias de Norte a Sul do país.
O presidente da APP, Manuel Azevedo Portela, considera que o êxito alcançado durante a primeira fase da campanha, em Julho, justifica o regresso à medida, considerando que “os portugueses ainda estão pouco sensibilizados para a importância da saúde dos pés e ignoram as doenças que os afectam, o que pode originar complicações graves como dificuldades em andar”. Os primeiros rastreios gratuitos vão ter lugar já a partir de dia 31 deste mês, das 10 às 17 horas, arrancando no distrito de Leiria: na Farmácia Laranjeira Pais, na Farmácia Lis, na Farmácia Duarte e na Farmácia Fátima. O podologista salienta que “os rastreios são importantes para prevenir, aconselhar e tratar as doenças dos pés, e são também um incentivo para as pessoas pensarem na sua saúde”.
Um estudo recente da Associação Portuguesa de Podologia, realizado em parceria com o Lamisil 1 da Novartis, revelou que 86 por cento dos portugueses sofre de doenças dos pés, sendo as mais frequentes as onicomicoses, o pé-de-atleta e as hiperqueratoses. No entanto, só 12 por cento já foram a uma consulta de podologia, enquanto 61 por cento não conhece qualquer medida para se prevenir, desconhecendo que o uso de chinelos e a higiene são essenciais. O Lamisil 1 consiste numa inovadora formulação galénica de um reconhecido medicamento fungicida, com base numa tecnologia revolucionária. Feita a aplicação, forma-se uma película protectora transparente que permite a libertação da substância activa que inicia a sua acção de imediato, atingindo concentrações fungicidas após 30 minutos, e mantendo-se activa durante 13 dias. Desta forma, o Lamisil 1 não só permite o rápido alívio dos sintomas do pé-de-atleta como protege o pé de recidivas ou reinfecções”, explicou, na sessão de lançamento do produto, em Abril, Sandra Miguel, a gestora da marca.
Carla Teixeira
Fonte: Associação Portuguesa de Podologia, Portal da Saúde, «O Primeiro de Janeiro»
REPORTAGEM
Genética usada no combate à depressão
 “A única maneira de saber se um medicamento vai funcionar é perscrevê-lo”. Quem o diz é Júlio Licini, chefe do Departamento de Psiquiatria da Universidade de Miami e assessor no norte-americano NIH para a área da Genética, que define a emissão de uma receita como um processo de “tentativa e erro”. No caso dos doentes com depressão, contudo, o erro soma vantagens. É que 20 por cento dos pacientes não respondem ao primeiro tratamento, e depois desse fracasso muitos desistem, por causa dos efeitos secundários. A Genética entra agora no receituário da terapia, e visa diminuir o tempo de avaliação da medicação, numa doença que pode matar...
“A única maneira de saber se um medicamento vai funcionar é perscrevê-lo”. Quem o diz é Júlio Licini, chefe do Departamento de Psiquiatria da Universidade de Miami e assessor no norte-americano NIH para a área da Genética, que define a emissão de uma receita como um processo de “tentativa e erro”. No caso dos doentes com depressão, contudo, o erro soma vantagens. É que 20 por cento dos pacientes não respondem ao primeiro tratamento, e depois desse fracasso muitos desistem, por causa dos efeitos secundários. A Genética entra agora no receituário da terapia, e visa diminuir o tempo de avaliação da medicação, numa doença que pode matar...Segundo avança a edição deste mês da revista científica «Galileu», poderá estar iminente uma mudança de cenário no funcionamento do tratamento da depressão, em que actualmente se fica pelos 60 por cento a probabilidade de o médico acertar à primeira na terapia mais adequada para o doente. Os especialistas frisam mesmo que 20 por cento dos doentes não respondem ao primeiro medicamento indicado, e normalmente só depois de três a quatro semanas em que estão sujeitos a inúmeros efeitos adversos – boca seca, insónia e taquicardia, entre outros – percebem que a terapia prescrita falhou. O impulso é, em muitos casos, largar o tratamento, fazendo com que um episódio agudo de depressão se torne uma doença crónica.
Tal como o farmacia.com.pt noticiou na edição do passado dia 9, tendo por base os dados de um estudo publicado pelo Instituto Nacional de Saúde Ricardo Jorge, a ansiedade, a depressão e as perturbações do sono são os diagnósticos que mais têm motivado a prescrição de psicofármacos na medicina geral e familiar no nosso país, cuja tendência tem sido crescente e muitas vezes, como o Portal da Farmácia e do Medicamento também já deu conta, inadequada. Uma posição secundada por especialistas norte-americanos numa investigação recente, que dá conta de que o recurso à psicoterapia como único meio de tratamento das pessoas com depressão clínica pode não dar resultado, mas, pior do que isso, pode piorar o quadro clínico do paciente, uma vez que o cérebro deprimido poderá sofrer de uma falha na conexão entre neurónios.
Nos episódios de tristeza profunda que não seja motivada por problemas físicos ou acontecimentos do quotidiano, e dos quais o doente não consegue recuperar sem o apoio especializado, os neurónios podem impedir melhorias, segundo atestam dados de um estudo levado a cabo por uma equipa de investigadores da Universidade de Wisconsin-Madison, nos Estados Unidos, publicada há dias no prestigiado «Journal of Neuroscience». A chamada “depressão maior”, que tem uma motivação difícil de apurar à partida, por não ter a ver com eventos recentes ou conhecidos na vida dos pacientes, poderá ser causada, segundo os especialistas, por uma falha no cérebro que impede a conexão entre neurónios, inviabilizando o “pensamento positivo”, cuja acção é muitas vezes preponderante, em pessoas saudáveis, para estádios mais ou menos passageiros de tristeza.
Bioquímica da depressão
Os transtornos do estado de ânimo do doente depressivo poderão ter relação com uma eventual redução do ritmo de transmissão dos impulsos ou sinais nervosos na área cerebral que regula o humor. Várias teorias actuais apontam para a existência de causas biológicas para a depressão, focalizando-se na possibilidade de haver uma falha na neurotransmissão. O cérebro dos indivíduos que se encontram numa fase depressiva da doença bipolar ou de uma depressão crónica ou profunda pode apresentar pequenas quebras na utilização dos neurotransmissores monoaminas (noradrenalina e dopamina) e da serotonina (5-HT), embora na depressão unipolar profunda não haja, na maioria das vezes, qualquer alteração, e na forma moderada da depressão unipolar elas sejam inexistentes ou pouco significativas.
Os fármacos eficazes no tratamento da depressão agem aumentando os níveis de alguns daqueles neurotransmissores: a dopamina, a adrenalina e a serotonina são importantes na produição do efeito de satisfação. No entanto, no ano passado uma equipa internacional de investigadores descobriu uma substância endógena que se crê possa estar directamente associada ao evento da depressão: níveis reduzidos de p11, proteína que modula a actividade das células cerebrais à serotonina, foram encontrados em pessoas deprimidas e em ratos a que tinham sido artificialmente induzidas depressões. A descoberta, publicada na revista «Science», constituiu na altura um importante avanço no tratamento da depressão e das alterações do sono.
Em Portugal
Condição médica que afecta 20 por cento da população portuguesa, a depressão é hoje a principal causa de incapacidade e a segunda mais importante razão para a perda de anos de vida saudável, num «ranking» dos 107 problemas de saúde mais relevantes no nosso país. Com custos pessoais e sociais muito elevados, que em muitos casos chegam ao limite do suicídio – a depressão está associada à perda de 850 mil vidas por ano em todo o mundo, cerca de 1200 só no nosso país –, trata-se de uma doença que afecta uma em cada quatro pessoas no mundo, que já sofreu, sofre ou virá a sofrer dos seus sintomas ao longo da vida. No caso português, um em cada cinco utentes dos cuidados de saúde primários encontra-se deprimido no momento da consulta.
Os médicos portugueses baseiam-se sobretudo na sintomatologia emocional para diagnosticar e tratar a depressão, que é reconhecida no Plano Nacional de Saúde 2000/2010 como “um problema primordial de saúde pública”. Um estudo recente no nosso país demonstrou que 22,8 por cento dos doentes tratados em Portugal sofre de depressão, e que 80,5 por cento desse universo apresenta um diagnóstico pré-existente, enquanto 19,5 por cento representam novos casos. Em grande parte dos casos (43,5 por cento), a depressão prevalece entre os 30 e os 50 anos. No âmbito de uma investigação em que 69 por cento dos participantes era do sexo feminino, 73,1 por cento dessas mulheres sofria de depressão com ansiedade, e uma franja de 55,7 por cento desenvolvia sintomas físicos da doença.
Em 74,2 por cento dos doentes acompanhados no estudo a depressão apresentou-se nas formas ligeira a moderada, e 60 por cento dos pacientes tiveram pelo menos uma recaída. Os médicos reconhecem, em 58,4 por cento dos casos, que utilizam os sintomas físicos como meio para aferir o diagnóstico, mas apenas 10 por cento mencionam a existência de dores, mas é a tristeza (76,4 por cento) que prevalece como sintoma mais recorrente da doença depressiva. A comunidade médica está, no entanto, convencida de que o tratamento dos sintomas emocionais culminará no tratamento dos sintomas físicos, segundo declararam 83,2 por cento dos clínicos. A convicção de que os doentes conseguirão atingir a remissão se os sintomas forem tratados foi expressa por 74,9 por cento dos médicos auscultados neste estudo.
Carla Teixeira
Fonte: Revista Galileu, Portal da Saúde, European Alliance Against Depression, Wikipedia, G1
Philips desenvolve sistema de voz para radiologistas
Os radiologistas da Aberdeen Royal Infirmary (ARI), na Escócia, podem agora controlar todos os passos da criação de ficheiros clínicos electrónicos através de um sistema de reconhecimento de voz.
O sistema foi implantado pela Philips e utiliza a tecnologia SpeechMagic que é considerado pela empresa como o “maior sistema front-end” existente no sector de saúde no Reino Unido.
Segundo esclarece um comunicado da Philips (Medical Systems), os 60 radiologistas daquela unidade de saúde escocesa conseguem “criar e enviar relatórios de forma mais rápida, uma vez que, passam a ser ditados e automaticamente tornados em texto (não precisando de ser transcritos), processo este que chegava a demorar semanas neste estabelecimento.”
Assim, a tecnologia SpeechMagic da Philips proporciona aos médicos o acesso a informação “em tempo útil para melhorar o tratamento dos seus doentes”, destacou a empresa, acrescentando que “o sistema permite ainda visualizar o historial do utente num ecrã, onde os clínicos poderão comparar as informações com resultados anteriores.”
Raquel Pacheco
Fonte: site Philips (Medical Systems)
Estudo demonstra que a vacina contra o VPH não acelera a diminuição do vírus
O estudo consistiu na análise das reacções perante a administração da vacina para o VPH tipo 16 e 18 ou para o vírus da hepatite num grupo de 2.189 mulheres, com idades entre os 18 e os 25 anos, que tiveram resultado positivo nos testes ao VPH no ADN.
Os resultados demonstraram que a vacina do VPH não altera as taxas de diminuição do vírus. Não houve evidência de um aumento da eliminação da carga viral aos seis ou 12 meses no grupo que recebeu a vacina contra o VPH, em comparação com o grupo de controlo. As taxas de eliminação das infecções do VPH 16/18 até aos seis meses foram de 33,4 por cento no grupo de pacientes que recebeu a vacina, em relação aos 31,6 por cento do grupo de controlo. A taxa de eliminação do vírus aos 12 meses foi de 48,8 por cento no grupo que recebeu a vacina e de 49,8 por cento no grupo de controlo. No que se refere aos resultados citológicos e à carga viral do VPH, os resultados dos anticorpos de VPH 16/18 não apresentaram evidências dos efeitos da vacinação. Não foi identificado um efeito terapêutico, nem para as situações oncológicas do VPH, nem para as não oncológicas. Isto verificou-se tanto entre as mulheres que receberam todas as doses da vacina, entre as que apresentavam infecções simples, ou entre as que foram estratificadas pelas seguintes variáveis: serologia de VPH 16/18, resultados citológicos, carga viral de VPH no ADN, tempo decorrido desde a primeira relação sexual, infecções por Chlamydia trachomatis ou por Neisseria gonorrhoeae, utilização de contraceptivo hormonal, ou fumadoras.
Perante os dados obtidos, o estudo conclui que as vacinas contra o VPH, delineadas para prevenir a infecção e o desenvolvimento de lesões pré-cancerígenas e o cancro cervical, não aceleram a eliminação do vírus e não deveriam ser utilizadas para tratar as infecções prevalentes.
Isabel Marques
Fontes: AZprensa.com, http://jama.ama-assn.org
Glenwood Systems cria ficheiros clínicos electrónicos e gratuitos
De acordo com a informação ventilada pela mesma fonte, esta empresa norte-americana de soluções tecnológicas destacou-se no plano da inovação ao criar um modelo de distribuição software como serviço gratuito (sem custos, encargos ou licenças) recorrendo a "um sistema de anúncios que cobre os custos da solução.”
Congratulando-se com estratégia pioneira no mercado, o presidente da Glenwood, Nat Loganathan, sublinhou - em comunicado citado pela agência de comunicação - que o novo sistema “representa um importante passo pela facilidade que gera na adopção dos ficheiros clínicos electrónicos por toda a comunidade médica.”
Para mais informações: http://www.GlaceEMR.com
Raquel Pacheco
Fontes: PR Newswire/www.glaceemr.com
sexta-feira, 17 de agosto de 2007
Monitorizar saúde no mundo em tempo real
Na nota a que o farmacia.com.pt teve acesso, a Comissão Europeia refere que este sistema visa “recolher e classificar automaticamente informação sobre saúde, com o intuito de complementar as abordagens tradicionais das autoridades no que concerne ao acesso à informação.”
Através do «MediSys» "o utilizador tem ao dispor informação que congrega um milhar de fontes noticiosas, assim como de 120 sites de saúde pública e em 32 línguas, podendo escolher o que quer consultar em tempo real", destacou.
Raquel Pacheco
Fonte: Comunicado site CE/iGOV
Medicamentos contrafeitos no mercado búlgaro
Numa semana particularmente atípica em termos de vigilância do sector farmacêutico em Portugal, com a Autoridade Nacional do Medicamento e dos Produtos de Saúde a publicar sucessivas circulares dando conta da recolha de fármacos e outros artigos, foi no mercado búlgaro que acabaram por ser detectados produtos contrafeitos.
De acordo com uma nota emitida ao final da tarde desta sexta-feira pelo Infarmed, e que é assinada pela vice-presidente do conselho de administração daquela entidade, Luísa Carvalho, e com carácter urgente, informa-se que diversos lotes dos medicamentos kamagra (suspensão oral, sildenafil, 100mg -5g, lote 0436.A; suspensão oral, sildenafil, 100mg -5g, lote 0436.C; suspensão oral, sildenafil, 100mg -5g, lote 0436.E; comprimidos, sildenafil, 100mg x 4, com prazo de validade até Janeiro de 2010), Lovegra (suspensão oral, sildenafil, 100mg -5g, lote 0406.M), Apcalis (suspensão oral, tadalafil + sildenafil, 20mg -5g, lote 1964.C) e Lovegra (comprimidos, tadalafil + sildenafil, 100mg x 4, com prazo de validade até Janeiro de 2010) foram recolhidos do mercado farmacêutico búlgaro.
Na sequência do alerta recebido pela Agência do Medicamento da Bulgária, o Infarmed informa que os referidos terão sido fabricados na Índia pelo fabricante Ajanta Pharma Limited e não dispõem de autorização de introdução no mercado daquele país, tal como não a têm em Portugal. Por isso a entidade reguladora lusa avisa que a comercialização de qualquer um daqueles medicamentos é proibida no nosso país, e exorta as pessoas que eventualmente estejam a utilizar aqueles fármacos para suspenderem de imediato a sua administração, ao mesmo tempo que notifica as entidades envolvidas no processo de veiculação farmacológica de que a venda é ilícita, mesmo por via electrónica, já que qualquer um daqueles produtos representa um risco sério para a saúde pública.
Carla Teixeira
Fonte: Infarmed
Orencia chega ao Brasil em Setembro
 Medicamento da Bristol para a artrite reumatóide inaugura nova classe de fármacos biológicos para doenças auto-imunes
Medicamento da Bristol para a artrite reumatóide inaugura nova classe de fármacos biológicos para doenças auto-imunesÉ o primeiro produto biológico desenvolvido nos laboratórios da farmacêutica Bristol-Myers Squibb Pharmaceuticals Limited e está a ser comercializado no mercado norte-americano desde Março de 2006. Ao Brasil – o medicamento indicado para a terapêutica da artrite reumatóide – chega já em Setembro.
O Orencia (abatacepte) foi, recentemente, aprovado pela Anvisa (Agência Nacional de vigilância Sanitária), no Brasil, e é o primeiro de uma nova linha de medicamentos biológicos para doenças auto-imunes - doenças decorrentes de desequilíbrios no sistema imunológico do organismo humano.
De acordo com o portal SEGS, durante o período de experimentação do fármaco, o Brasil terá participado “activamente.” E embora em menor número que nos Estados Unidos, os protocolos clínicos (fase de ensaios em humanos) registaram, também, uma adesão “significativa” de doentes.
O Orencia marca a diferença entre outros medicamentos disponíveis, porque representa uma evolução no tratamento, ou seja, na forma de actuar, “pela melhor combinação de eficácia e segurança”, assegura a Bristol.
Trata-se de uma proteína de fusão que modula a co-estimulação dos linfóticos T, responsáveis pelo desencadeamento do processo inflamatório que caracteriza a artrite reumatóide. O medicamento consegue neutralizar estas células modulando, selectivamente, um dos sinais de activação da inflamação associada à doença, interrompendo este processo.
Portugal: doença afecta 100 mil
A artrite reumatóide é uma inflamação das articulações, que provoca a alteração das estruturas ósseas e das cartilagens. A etiologia é desconhecida, mas sabe-se que afecta a mulher duas vezes mais que o homem. Segundo os dados da Associação Nacional dos Doentes com Artrite Reumatóide (ANDAR), em Portugal, a doença afecta cerca de 100 mil pessoas. No Brasil, atinge quase 2 milhões.
Nos últimos 15 anos, o tratamento evoluiu significativamente, em consequência da avaliação da actividade inflamatória, do conhecimento dos factores de pior prognóstico, do uso precoce de fármacos anti-reumáticos de acção lenta, do aparecimento de terapêutica combinada e, mais recentemente, da terapêutica biológica.
Raquel Pacheco
Fontes: SEGS/Manual Merk/ANDAR/site Pfizer
Vírus do Nilo: descoberta variante mais severa
 Cientistas identificaram mutação genética e localizaram-na nos EUA
Cientistas identificaram mutação genética e localizaram-na nos EUAO vírus do Nilo Ocidental “tornou-se mais perigoso e mais apto a colonizar novos territórios.” A conclusão saiu de um estudo divulgado na revista científica «Nature Genetics», onde os autores da investigação afirmam ter identificado a mutação genética que originou as variantes mais graves do vírus.
De acordo com a equipa de investigadores norte-americana que conduziu o estudo, o resultado permitiu concluir que uma mutação similar já se produziu nas últimas epidemias do vírus provocando diversas mortes, incluindo a Europa e Israel.
Segundo avança também a agência AFP, as variantes agora identificadas “são responsáveis por focos de encefalite mortais que foram detectados durante os últimos anos em vários locais, nomeadamente, nos Estados Unidos”, por isso, os cientistas acreditam que o vírus sofreu novas mutações ao atingir o continente americano.
Ao conseguirem reproduzir a mutação T249P no gene que codifica a enzima helicase, os cientistas verificaram que esta é a responsável pela maior virulência do vírus do Nilo Ocidental: "Quando uma cepa pouco virulenta do Quênia se manipulou para conter a mutação do helicase, ficou comprovado que se duplicava mais rapidamente e causava a morte de um corvo americano que tinha sido inoculado com mais rapidez que a do vírus queniano original" explicaram.
Os resultados do estudo revelam que “é possível que vírus como o do Nilo Ocidental se adaptem rapidamente a mudanças do meio ambiente, com consequências imprevisíveis para a saúde humana", sublinhou Aaron Braul, o coordenador da investigação realizada na Universidade da Califórnia (EUA).
O vírus do Nilo Ocidental é comumente conhecido como Febre do Nilo Ocidental, enquanto as formas mais fortes, que são potencialmente mortais, podem receber a denominação de Encefalite ou Meningite do Nilo
Ocidental.
A doença manifesta-se por sintomas de encefalite, tremores e febre alta. Nos casos mais severos, pode provocar o estado de coma e a morte. Na maioria dos casos, a infecção é benigna para o homem na Europa, mas nos Estados Unidos já causou a morte de 177 pessoas neste ano e infectou 4.200.
O vírus disseminado em mosquitos foi identificado, pela primeira vez, em 1937, em Uganda. Segundo o «MedlinePlus», nos EUA foi descoberto no Verão de 1999, em Nova Iorque.
Raquel Pacheco
Fontes: «Nature Genetics»; Agências EFE/AFP
Angola luta contra sarampo
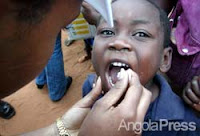 Campanha de vacinação a bom ritmo
Campanha de vacinação a bom ritmoAngola está reforçar a luta para baixar a taxa mortalidade infantil causada pelo sarampo. Mais de mil doses de vacinas estão a ser usadas numa campanha que decorre, desde o dia 13 deste mês, nos postos fixos espalhados na província do Huambo.
A previsão assustadora de que o sarampo possa atingir um universo de 45 mil crianças dos 6 meses aos 5 anos de idade, levou Angola a iniciar, esta semana, uma batalha contra a doença.
Raquel Pacheco
Fonte: Lusa (sector Áfricanet)/SaúdePública
OMS: Doentes cardíacos devem evitar assistir ao vivo aos JO Pequim 2008
Michal Krzyzanowski, médico da OMS, aconselha aqueles que têm histórico de problemas cardiovasculares a reconsiderarem uma eventual visita à capital chinesa durante as Olimpiadas de Pequim. Em declarações á BBC, o especialista acrescenta ainda que a baixa qualidade do ar pode dar origem a ataques de asma.
As autoridades de Pequim estão a esforçar-se para diminuir as emissões poluentes, ainda assim a OMS considera que o bem-estar de algumas pessoas pode estar em risco. "Todas as cidades estão altamente poluídas segundo padrões europeus, mas mesmo para os padrões da Ásia, as cidades chinesas têm alta poluição", salientou o médico.
Segundo Krzyzanowski, "o principal problema nas cidades chinesas é a poluição atmosférica, pequenas partículas que ficam em suspensão no ar e penetram nos pulmões". Para além disso, “invadem outros sistemas, com o cardiovascular e viajam pelo sangue e pelo organismo”.
Segundo o especialista, o stress inerente aos espectáculos desportivos e o calor, aliados à baixa qualidade do ar são motivos mais do que suficientes para que os potenciais espectadores, que não estejam de perfeita saúde, se desloquem à cidade.
Marta Bilro
Fonte: BBC, Último Segundo.
Descontentamento é demasiadas vezes confundido com depressão, diz especialista
Gordon parker argumenta que o problema foi reduzido ao “absurdo” e que se incorre no risco de medicar o sofrimento humano normal procurando qualquer sinal de depressão que justifique a administração de um tratamento. Os parâmetros que definem a depressão clínica são baixos, afirma o professor da Universidade Australiana de New South Wales, e os médicos acabam por tratar uma emoção normal como uma doença do foro psíquico. Para além do mais, acrescenta, “é normal estar-se deprimido”.
Ian Hickie, também especialista em psiquiatria, não partilha da mesma opinião por considerar que o aumento dos diagnósticos relacionados com a depressão conduziu à redução dos suicídios e dissipou o antigo estigma em torno da doença mental. O mesmo aponta Marjorie Wallace, da SANE, ao salientar que “é preferível arriscar um sobre-diagnóstico do que deixar uma depressão por tratar”.
”A depressão pode ser uma condição complexa e desafiante que varia entre a pessoa sentir-se em baixo a sensação de inércia total que pode fazer com que o indivíduo seja incapaz de se levantar da cama de manhã, de manter as suas relações pessoais ou o trabalho”, sublinha Wallace.
Sob as novas linhas de diagnóstico, um em cada cinco adultos sofre de depressão durante a sua vida – o que custa milhões ao Estado, em produtividade perdida e tratamentos. De acordo com o Portal da Saúde, a depressão é a principal causa de incapacidade e a segunda causa de perda de anos de vida saudáveis entre as 107 doenças e problemas de saúde mais relevantes. Os custos pessoais e sociais da doença são muito elevados. Uma em cada quatro pessoas em todo o mundo sofre, sofreu ou vai sofrer de depressão. Um em cada cinco utentes dos cuidados de saúde primários portugueses encontra-se deprimido no momento da consulta.
Marta Bilro
Fonte: Sol, Guardian Unlimited, Scotsman.com, Hindustan Times, Portal da Saúde.
Doentes não devem parar ingestão de Euglucon e Semi-Euglucon
Depois de ter retirado do mercado o Euglucon e Semi-Euglucon, a Autoridade Nacional do Medicamento e Produtos de Saúde (Infarmed) vem agora dizer que o risco de descompensação metabólica por paragem abrupta deste medicamento é considerado mais perigoso para a saúde dos doentes. Nesse sentido, a toma do fármaco não deve ser interrompida.
O fármaco foi recolhido devido ao incumprimento das especificações relativas aos parâmetros de dureza do produto acabado e à presença de uma impureza, a sulfonamida, a qual, quando administrada em altas doses, pode estar associada a reacções adversas e interacções medicamentosas. Isto não se verifica nas doses terapêuticas habitualmente utilizadas, refere o Infarmed, pelo que “os doentes não devem parar de tomar a medicação anti-diabética com Euglucon e Semi-Euglucon, por risco de descompensação da sua diabetes”, alerta a circular informativa divulgada esta sexta-feira.
Ainda assim, logo que possível, deve ser contactado o médico assistente para que seja feita a substituição do medicamento por outro disponível no mercado com a mesma substância activa ou outra apropriada a cada caso individual.
Marta Bilro
Fonte: Infarmed.
Celebrex pode impedir novo bloqueio das artérias em doentes submetidos a angioplastia
A investigação contou com a participação de 274 pacientes submetidos a uma angioplastia, procedimento que consiste, essencialmente, na introdução de um cateter no interior da artéria no fim do qual existe um balão insuflável. A parte do cateter que contém o balão insuflável é colocada no local do bloqueio que, depois de bem posicionado, é inflado expandindo dentro da artéria obstruída. O balão expandido força a abertura do bloqueio empurrando as paredes das artérias para fora. A artéria permanecerá aberta, pois as paredes foram esticadas e alguns dos depósitos na parede foram quebrados, restaurando o fluxo sanguíneo.
Todos os voluntários estavam a ser medicados com Plavix (Clopidogrel) e aspirina, sendo que um grupo de 136 pessoas tomou também Celebrex antes da cirurgia e, posteriormente, durante um período de seis meses. No final do tratamento os investigadores observaram que o diâmetro interior dos cateteres implantados nos pacientes aos quais foi administrado o Celebrex era mais amplo relativamente aos doentes que apenas ingeriram anti-coagulantes.
“Estes dados sugerem que a utilização complementar [de Celebrex] durante seis meses após a implantação do cateter em pacientes com obstrução da artéria coronária é seguro”, referiram os investigadores. No entanto, uma nota adicional que acompanha a publicação do estudo lembra que os ensaios clínicos sugerem que a utilização prolongada do Celebrex pode expor os pacientes a um risco adicional de sofrer um ataque cardíaco, salientando por isso, que são necessárias mais pesquisas para confirmar a segurança do medicamento.
O celecoxib é um fármaco com uma actividade inibidora selectiva da ciclooxigenase-2 (COX-2), a mesma classe de substâncias na qual se insere o Vioxx (rofecoxib), o anti-inflamatório da Merck retirado do mercado depois de um estudo interno ter demonstrado que após 18 meses de tratamento, a toma do medicamento aumentava o risco de acidentes cardiovasculares.
Apesar das conclusões do estudo elaborado pela equipa de cientistas do Hospital da Universidade Nacional de Seúl serem animadoras, há ainda resultados contraditórios no que toca à segurança da utilização do celebrex. Nesse sentido, a Pfizer vai financiar um estudo de grandes dimensões especificamente traçado para analisar a segurança do fármaco. O ensaio clínico, que envolve a participação de 20 mil pacientes, não deverá estar terminado antes do final de 2010.
Marta Bilro
Fonte: Bloomberg, CNN Money, Setfarma.
